FÓRMULA LEUCOCITARIA
INTRODUCCIÓN
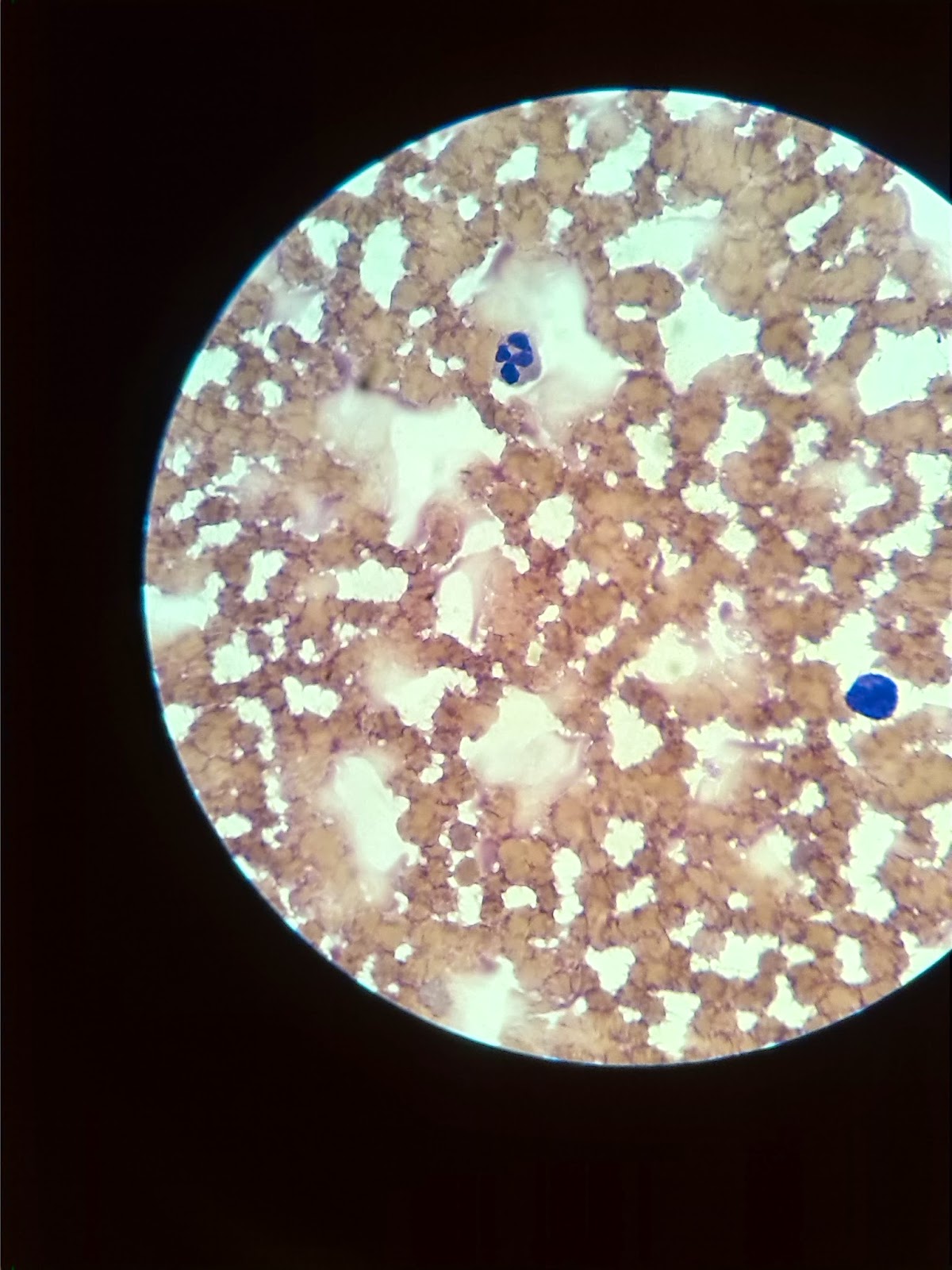
Realizamos una extensión de sangre y la teñimos con nuestro colante de uso habitual que será mediante la realizada anteriormente en la tinción de panóptico rápido.
La fórmula leucocitaria (RDL) consiste en la determinación del porcentaje que representa cada uno de los tipos de leucocitos con respecto al total de ellos.
MATERIAL
- Microscopio
- Portaobjetos
- Sangre
- Registrador automático de células o bien a mano con papel y boli
REACTIVOS
- Aceite de inmersión
- Solucion nº1, nº2, nº3 de panóptico rápido
TÉCNICA O PROCEDIMIENTO
- Comenzamos a enfocar con el objetivo de 10x, para comprobar que la preparación es buena y elegir una zona en la que los hematíes no estén superpuestos y los leucocitos se encuentren uniformemente distribuidos
- Ahora, enfocamos con el objetivo de inmersión que como bien sabemos es el de 100x
- Observar la zona mientras se describe el recorrido en forma de almenas o grecas, se clasifica y se cuentan los leucocitos que se van encontrando a lo largo del recorrido
OBSERVACIÓN
RESULTADOS OBTENIDOS
- Realizamos la observación, sería dibujada en una columna mediante papel y boli, que sería la siguiente:
Neutrófilos en cayado= IIIIIIIIIIIIIIIIIIIIIIIII (Hay 25)
Linfocitos= IIIIII (Hay 6)
Monocitos= encontramos 0
Eosinófilos= encontramos 0
Basófilos= IIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIIII (Hay 42)
Por ejemplo, los basófilos es propio de alergias respiratorias, y ciertamente la sangre que hemos extraído es de nuestra compañera que carece de alergias.
- Cuanto mayor es el número de leucocitos contados, más exacta es la determinación. En la práctica sólo se cuenta 100 o 200 leucocitos como máximo.
- Si se encuentra un mayor número de linfocitos que de neutrófilos o más de un 10% de eosinófilos o más de 12% de monocitos, el RDL se hace contando 200 leucocitos y dividiendo, posteriormente, el resultado obtenido entre 2.
- Si se conoce el WBC de la sangre, se puede calcular el número de cada uno de los tipos de leucocitos que está presente en 1mm3 de sangre nºTL= WBCxTL/100
h&sa=X&ei=yIyFVPLJE8mqU5yIgvgP&ved=0CAYQ_AUoAQ#tbm=isch&q=
observacion+microscopica+de+leucocitos&facrc=_&imgdii=_&imgrc=rF3YkrjeNBb5BM%253A%3BHJ-vEEWYWBKvBM%3Bhttp%253A%252F%252F3.bp.blogspot.com%252F-ltNbipYX9rc%252FT-Fa3srlXNI%252FAAAAAAAAAVM%252FvHOfyrxQBeI%252Fs1600%252Fleucocitos.jpg%3Bhttp%253A%252F%252Flaboratorio-clinico-612.blogspot.com%252F2012%252F06%252Fhemograma-en-medicina-el-hemograma-o.html%3B505%3B335
HOJA DE TRABAJO
A) ¿Con qué objetivo se observan los leucocitos cuando se determina una fórmula leucocitaria?
Comenzamos con el objetivo de 10x, y posteriormente con el de 100x, es decir el de inmersión
B) ¿Cómo es el recorrido que se describe en la observación leucocitaria?
Almenas o grecas
C) ¿Cuándo se han de observar al menos 200 leucocitos?
Cuando hay un nº de linfocitos que de neutrófilos o mas de un 10% de eosinófilos o 2% de monocitos
D) Si de 100 leucocitos observados, 20 son linfocitos y el WBC es igual a 7000 leucocitos/mm3 de sangre, ¿cuál es el número de linfocitos que hay en 1mm3 de sangre?
7000x20/100 1400 leucocitos en sangre total
E) ¿Cómo se llama el aumento de los monocitos?
Monocitosis
VALORACIÓN DE LOS RESULTADOS
En las angre estudiada: La proporción de leucocitos es normal